四省藥監局聯合發文(wén) 新醫(yī)械聯盟來(lái)了(le)
重磅進展,長(cháng)三角醫(yī)療器(qì)械注冊人(rén)制(zhì)度一(yī)體(tǐ)化(huà)形成。
四省組成,新聯盟形成
10月(yuè)29日(rì),據江蘇省藥品監督管理(lǐ)局消息,上(shàng)海(hǎi)、江蘇、浙江、安徽四地(dì)藥監局聯合發布《↑長(cháng)江三角洲區(qū)域醫(yī)療器(qì)械注冊人(rén)制(zhì)度試點工(gōng)作(zuò)實施方案》。
據悉,這(zhè)次的(de)大(dà)舉措是(shì)按照(zhào)國(guó)家(jiā)藥品監督管理(lǐ)局《關于擴大(dà)醫(yī)療器(qì)械注冊人(rén)試點工(gōn∞g)作(zuò)的(de)通(tōng)知(zhī)》的(de)要(yào)求來(lái)進行(xíng),以長(cháng)江三角洲區(qū)域醫(yī)療器(qì)械産業(yè)一(yī)體(tǐ)化(huà)。
由此可(kě)以看(kàn)出,長(cháng)三角醫(yī)療器(qì)械注冊人(rén)制(zhì)度一(yī)體(tǐ)化(huà)形成。“醫(yī)療器(qì)械注冊人(rén✘)制(zhì)度”這(zhè)一(yī)醫(yī)療器(qì)械行(xíng)業(yè)的(de)創新性的(de)改革,最早從(cóng)上(shàng)海(hǎi)試點,後擴大(dà)到(dδào)天津、廣東(dōng)兩地(dì)。
2019年(nián)8月(yuè),國(guó)家(jiā)藥監局相(xiàng)關通(tōng)知(zhī)又(yòu)明(míng)确,北(běi)京、天津、河(hé)北(běi)、遼甯∑、黑(hēi)龍江、上(shàng)海(hǎi)、江蘇、浙江、安徽、福建、山(shān)東(dōng)、廣東(dōng)等21個(gè)♦省、自(zì)治區(qū)、直轄市(shì)參加醫(yī)療器(qì)械注冊人(rén)制(zhì)度試點。
怎麽聯合?有(yǒu)什(shén)麽影(yǐng)響?
什(shén)麽是(shì)醫(yī)療注冊人(rén)制(zhì)度,經曆了(le)怎樣的(de)變革?
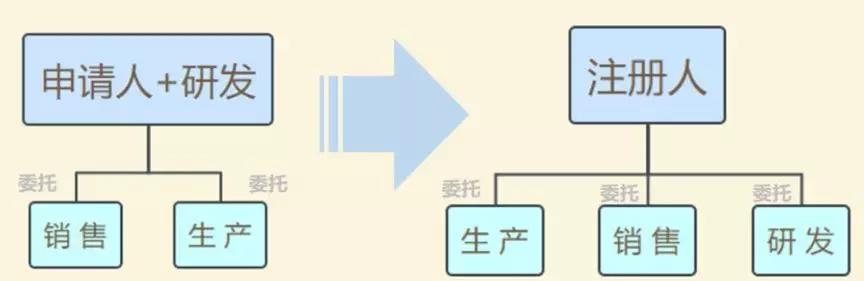
此前,在2014年(nián)10月(yuè)起實施的(de)《醫(yī)療器(qì)械生(shēng)産監督管理(lǐ)辦法》中明(míng)确規定,拿•(ná)到(dào)醫(yī)療器(qì)械注冊證才能(néng)申請(qǐng)第二類、第三類醫(yī)療器(qì)械的(de)生(shēng)産許可(kě)證,而取∞得(de)生(shēng)産許可(kě)才能(néng)生(shēng)産、受托生(shēng)産相(xiàng)應醫(yī)療器(qì)械。也(yě)即把注冊與生(shēng)産↔許可(kě)捆綁在一(yī)起,必須由一(yī)個(gè)主體(tǐ)來(lái)完成。
現(xiàn)在,醫(yī)療器(qì)械注冊人(rén)制(zhì)度發生(shēng)改革,允許企業(yè)、機(jī)構和(hé)人(rén)員(yuán)單獨申請(qǐng)醫(yī)φ療器(qì)械注冊證,再以注冊人(rén)的(de)身(shēn)份委托其他(tā)企業(yè)生(✘shēng)産相(xiàng)應的(de)醫(yī)療器(qì)械。即注冊和(hé)生(shēng)産許可(kě)可(kě)以不(bù)由一(yī)個(gè)主體(tǐ)來(lái)完成。
模式變化(huà):
(圖片來(lái)源:CFDA法規在線)
“注冊人(rén)制(zhì)度實現(xiàn)了(le)産品注冊和(hé)生(shēng)産許可(kě)的(de)解綁,更利于鼓≈勵創新、整合社會(huì)資源、加快(kuài)醫(yī)療器(qì)械産品上(shàng)市(shì)”,上(shà≤ng)海(hǎi)市(shì)藥監局醫(yī)療器(qì)械監管處處長(cháng)林(lín)森(sēn)勇認為(wèi)。
多(duō)家(jiā)企業(yè)初嘗甜頭
在具體(tǐ)落實上(shàng),經國(guó)務院批準,行(xíng)業(yè)變局由上(shàng)海(hǎi)開(kāi)啓。
2018年(nián)2月(yuè)8日(rì),上(shàng)海(hǎi)遠(yuǎn)心醫(yī)療科(kē)技(jì)有(yǒu)限公司的(de)單道(dào)心電(d✔iàn)記錄儀獲得(de)由上(shàng)海(hǎi)市(shì)藥監部門(mén)頒發的(de)第二類醫(yī)療器(qì)械産品注冊證,成為(wèi)國(εguó)內(nèi)首個(gè)享受到(dào)醫(yī)療器(qì)械注冊人(rén)制(zhì)度新政的(de)産品。
持有(yǒu)注冊證的(de)遠(yuǎn)心醫(yī)療和(hé)受托生(shēng)産的(de)微(wēi)創電(diàn)生(shēng)理(lǐ)都(dōu)隸屬于上∑(shàng)海(hǎi)微(wēi)創,其由此成為(wèi)我國(guó)醫(yī)療器(qì)械注冊人(rαén)制(zhì)度試點的(de)首個(gè)赢家(jiā)。
上(shàng)海(hǎi)微(wēi)創醫(yī)療器(qì)械有(yǒu)限公司副總裁李勇說(shuō),從(cóng)我們企γ業(yè)試點實踐來(lái)看(kàn),新政大(dà)大(dà)節約了(le)研發成本投入。以我們首個(gè)獲得(de♣)試點注冊證的(de)産品為(wèi)例,節約了(le)1000多(duō)萬元研發投入。
嘗到(dào)甜頭的(de)上(shàng)海(hǎi)微(wēi)創,嘗試力度越來(lái)越大(dà)。✔截至目前,該企業(yè)已經有(yǒu)7家(jiā)公司12個(gè)産品申請(qǐng)注冊人(rén),其中有(yǒu)2個(gè)産品已獲得(de)注冊證。
據悉,除上(shàng)海(hǎi)微(wēi)創的(de)2個(gè)産品外(wài),上(shàng)海(hǎi)還(hái)有(×yǒu)4家(jiā)企業(yè)6個(gè)産品在試點過程中獲批。試點形式還(hái)出現(xiàn)了(le)擴大(dà)生(shēng)産場(chǎng)地(dì)、多(duō)&點委托,注冊人(rén)為(wèi)科(kē)研型企業(yè)、醫(yī)工(gōng)互動,非關聯主體(tǐ)跨區(qū)域委托、進口産品轉國(guó)産化(huà)≈等。
美(měi)敦力、邁瑞接連響應
醫(yī)療器(qì)械注冊人(rén)制(zhì)度可(kě)以縮短(duǎn)産品上(shàng)市(shì)周期、提高"(gāo)效率的(de)優勢已經顯現(xiàn),而且從(cóng)上(shàng)海(hǎi)的(de)實踐也(yě)能(néng)印證,制(zh→ì)度改革已經為(wèi)行(xíng)業(yè)帶來(lái)改變,國(guó)內(nèi)醫(yī)械龍頭企業(yè)也(yπě)接連“啓航”。
就(jiù)美(měi)敦力來(lái)說(shuō),與上(shàng)海(hǎi)微(wēi)創不(bù)同的(de)是(shì),美(měi)敦力的(de)委托生(shēng☆)産方為(wèi)捷普科(kē)技(jì)(上(shàng)海(hǎi))有(yǒu)限公司,這(zhè)是(shì)一(yī)家(jiā)專業(yè)的(de)第三 方代工(gōng)企業(yè)。以其獲批的(de)手術(shù)動力系統為(wèi)例,委托後,該産品獲批上(shàng)市(shì)僅用(yòng)了(le)45天的(de)時(shí)間↓(jiān)。
上(shàng)海(hǎi)市(shì)藥監局醫(yī)療器(qì)械注冊處處長(cháng)林(lín)峰就(jiù)此表示★,該産品原應作(zuò)為(wèi)進口産品注冊,但(dàn)在試點過程中是(shì)本地(dì)注冊、本地(dì)制"(zhì)造,使得(de)本地(dì)化(huà)轉移成為(wèi)可(kě)能(néng)。該産品上(shàng)市(shì)也(yě)意味著(zhe)将來(lái)我國(guó)會(huì )有(yǒu)更多(duō)先進醫(yī)療器(qì)械不(bù)再通(tōng)過進口,而是(shì)通(tōng)過本地(dì)注冊、生(shēng)産,實現(xiàn)快(kuài)£速上(shàng)市(shì)。
多(duō)方期待試點範圍擴大(dà)
從(cóng)目前各地(dì)實施的(de)結果來(lái)看(kàn),注冊人(rén)制(zhì)度試點工(gōng)作(zu≤ò)取得(de)一(yī)定成效,但(dàn)還(hái)存在一(yī)定問(wèn)題。
比如(rú)一(yī)些(xiē)企業(yè)将注冊人(rén)制(zhì)度簡單理(lǐ)解為(wèi)委托生(shēng)産,沒有(yǒu)意識到(d≥ào)注冊人(rén)要(yào)對(duì)醫(yī)療器(qì)械全生(shēng)命周期的(de)質量管理(lǐ)承擔主體(tǐ)責任;有(yǒu)些(xiē)企業(y è)為(wèi)享受試點期間(jiān)的(de)鼓勵政策(如(rú)優先審評等),刻意拆分(fēn)出持證$人(rén)或受托人(rén);部分(fēn)持有(yǒu)人(rén)和(hé)委托人(rén)之間(jiān)産生(shēng)知(zhī)識産權糾紛等。
需要(yào)看(kàn)到(dào)的(de)是(shì),由于目前試點範圍的(de)局限性,醫(yī)療器(qì)械注冊人(rén)制(zhì)度≤雖然不(bù)斷釋放(fàng)紅(hóng)利,但(dàn)是(shì)速率方面還(hái)需加強。
浙江省藥監局有(yǒu)關負責人(rén)坦言,資本的(de)逐利性決定其會(huì)選擇環境好(hǎo)✘、成本低(dī)的(de)地(dì)區(qū)進行(xíng)生(shēng)産。上(shàng)海(hǎi)的(de)生(shēng)産成本相(xi àng)對(duì)較高(gāo),注冊人(rén)完全可(kě)到(dào)周邊省份去(qù)尋找合作(zuò)夥伴。尤其是(shì)在“将長>(cháng)三角區(qū)域一(yī)體(tǐ)化(huà)發展上(shàng)升為(wèi)國(guó)家(ji✔ā)戰略”背景下(xià),注冊人(rén)試點應拓展到(dào)上(shàng)海(hǎi)周邊省份。
業(yè)內(nèi)人(rén)士就(jiù)此問(wèn)題談到(dào),在試點過程中,醫(yī)療器(qì)械注冊人(rén) 應當具備哪些(xiē)能(néng)力或者條件(jiàn),應當承擔哪些(xiē)義務;醫(yī)療器(qì)械注冊人♠(rén)制(zhì)度實施會(huì)給監管帶來(lái)哪些(xiē)挑戰,這(zhè)些(xiē)挑戰如(rú)何破解等問(wèn)題,還(hái)需進一(yī)步討(tǎo)↑論與研究,需要(yào)在實踐中不(bù)斷探索。
來(lái)源:賽柏藍(lán)器(qì)械



